Herzfehler sind häufig, aber teilweise potenziell vermeidbar. Welchen Einfluss haben maternale Erkrankungen, Umweltfaktoren, Medikamente, Ernährung etc., und wie kann man das Risiko für einen Herzfehler des Kindes reduzieren?
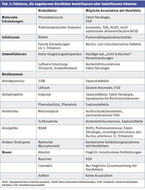
Angeborene Herzfehler sind häufige Fehlbildungen. Sie kommen bei 1 % der Neugeboren vor und sind eine führende Todesursache [1]. Etwa in 20 – 30 % der Fälle kann ein genetischer oder Umgebungsfaktor als Ursache identifiziert werden [2]. Die Ursachen können in hereditäre und nicht hereditäre multifaktorielle Ursachen aufgeteilt werden [3]. Nicht hereditäre Ursachen sind in Tabelle 1 zusammengefasst.
Die empfindlichste Periode der Organogenese des Herzens reicht von Woche 2 bis 7 der Embryonalentwicklung. Prophylaktische Maßnahmen können die Prävalenz nicht hereditärer Fehlbildungen des Feten im Allgemeinen, die Prävalenz angeborener Herzfehler oder die Prävalenz von Subtypen angeborener Herzfehler beeinflussen. So verhindert Folsäure, zur richtigen Zeit eingenommen, generell eine Reihe von Fehlbildungen, beispielsweise Neuralrohrdefekte, angeborene Herzfehler, Fehlbildungen der Harnwege und Lippen-Kiefer-Gaumen-Spalten [4], wobei die Evidenz für die unterschiedlichen Fehlbildungen nicht gleich hoch ist. Speziell senkt Folsäure aber nachweislich das Auftreten angeborener Herzfehler [5]. Dies betrifft mit der höchsten Evidenz das Auftreten konotrunkaler Fehlbildungen und Aortenisthmusstenosen, weniger ausgeprägt ist der Zusammenhang bezüglich Septumdefekten [6].
Nicht hereditäre vorgeburtliche Risiken für angeborene Herzfehler sind in einem Statement der American Heart Association und der American Academy of Pediatrics aus dem Jahr 2007 zusammengefasst [3]. Neuere Studien auf diesem Gebiet sind aus ethischen Gründen kaum noch Interventionsstudien. Dieser Artikel fasst auf der Basis der oben erwähnten vor gut 10 Jahren verfassten Statements die aktuellen Empfehlungen und die Literatur zur Prävention angeborener Herzfehler in der Schwangerschaft zusammen.
Maternale Erkrankungen
Stoffwechselerkrankungen
Die Phenylketonurie ist mit einem über 6-fach höheren Risiko für Herzfehler, insbesondere hinsichtlich konotrunkaler Defekte und Einkammerherzen, assoziiert. Eine strikte Diät der Mutter, die bereits vor der Konzeption eingehalten wird, kann dieses Risiko nachweislich reduzieren [7].
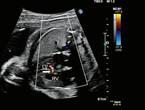
Vorbestehender Diabetes mellitus ist ein klassischer "Umgebungsfaktor", der für Herzfehler prädisponiert (Abb. 1). Dabei werden verschiedene zugrundeliegende Mechanismen diskutiert, die unter anderem Zellproliferation und -migration sowie Apoptose involvieren [8]. Die Erhöhung des Risikos für angeborene Herzerkrankungen wird bei maternalem Diabetes für die Nachkommen auf 4 % gegenüber 1 % in der Normalpopulation geschätzt [9].
Mütterliche febrile Erkrankungen und Infektionen
Aufgrund der Rötelnerkrankung wurde der Zusammenhang zwischen mütterlicher febriler Erkrankung in der frühen Schwangerschaft und Fehlbildungen des Feten entdeckt. Die Rötelninfektion ist mit Abnormitäten der Pulmonalklappe und Ventrikelseptumdefekten assoziiert. Eine konsequente Impfstrategie kann die vertikale Transmission praktisch komplett verhindern [10].
Influenza und mütterliche febrile Erkrankungen im 1. Trimenon sind generell mit einer erhöhten Inzidenz angeborener Herzfehler assoziiert, wobei die Ursache des Fiebers und auch die Einnahme von Vitaminsupplementen eine Rolle spielen [11]. Eine Influenzaimpfung wird entsprechend auch zu jedem Zeitpunkt der Schwangerschaft empfohlen.
Toxoplasmose, Influenza, Coxsackie und HIV sind weitere Infektionen, die mit Fehlbildungen des fetalen Herzens in Zusammenhang gebracht werden.
Umweltfaktoren
Physikalische Einwirkungen
Hohe Umgebungstemperaturen im 1. Trimenon sind möglicherweise mit nicht kritischen Herzerkrankungen assoziiert und insofern möglichst zu vermeiden [12].
Luftverschmutzung: Eine Metaanalyse epidemiologischer Studien zum Thema Luftverschmutzung und angeborene Herzfehler ergab eine Assoziation zwischen Stickoxid- und Schwefeldioxidexposition mit Aortenisthmusstenose und Fallot-Tetralogie [12]. Feinstaubexposition war mit Vorhofseptumdefekten assoziiert.
Medikamente: Medikamente werden von der amerikanischen Arzneimittelbehörde FDA nach einem speziellen Schema eingeteilt, das auf vorhandener oder nicht vorhandener Evidenz für fetale Fehlbildungen beruht [14] (Tab. 2). Generell müssen im Einzelfall das Risiko und der Nutzen mit der Schwangeren individuell besprochen werden.
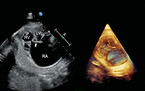
Antidepressiva: Selektive Serotonin-Wiederaufnahmehemmer (SSRI) wie Paroxetin und Sertralin werden vor allem im Zusammenhang mit Septumdefekten genannt [14]. Das tatsächliche Risiko ist jedoch fraglich, und einige große Studien konnten einen Zusammenhang nicht bestätigen, sodass die Datenlage kontrovers bleibt [15]. Lithium wird für bipolare Störungen eingesetzt und mit einem Risiko für Ebstein-Anomalie und Ventrikelseptumdefekte in Verbindung gebracht (Abb. 2); dieses Risiko wird jedoch oft überschätzt und beträgt etwa 1:2.000 [14, 16].
Antiepileptika: Valproat erhöht das Risiko von Neuralrohrdefekten und angeborenen Herzfehlern (Septumdefekte, Fallot-Tetralogie, hypoplastische Rechtsherzläsionen). Es gilt als teratogen und soll nach Möglichkeit in der Schwangerschaft entweder vermieden werden oder die Schwangere muss über das erhöhte Risiko aufgeklärt werden. Das Risiko ist vor allem im 1. Trimester erhöht. Ähnliches gilt auch für Phenobarbital und Phenytoin [17]. Weniger hoch ist das Risiko bei Lamotrigin und Levetiracetam.
Antibiotika: Metronidazol während der Schwangerschaft war in der Baltimore Washington Infant Study mit Ausflusstraktanomalien und perimembranösen Ventrikelseptumdefekten assoziiert. Dies hat sich in 2 späteren Metaanalysen nicht bestätigt. Sulfonamide wie Trimethoprim-Sulfamethoxazol erhöhen das Risiko für angeborene Fehlbildungen des Herzens auch bei Behandlung im 2. und 3. Monat der Schwangerschaft [18].
Analgetika: In einer älteren großen Registerstudie zu nicht steroidalen Antirheumatika (NSAR) fand sich eine Assoziation mit Herzfehlern [19]. Insbesondere Ibuprofen gilt als FDA-Kategorie B (Tierversuche haben kein Risiko gezeigt; keine kontrollierte Studien bei schwangeren Frauen). Eine Fall-Kontroll-Studie zur Assoziation von Analgetika und kardiovaskulären Malformationen der bereits genannten Baltimore Washington Infant Study ergab keine Assoziation mit kardiovaskulären Fehlbildungen [20]. Eine Studie, in der man Paracetamol mit Opioiden und NSAR verglich, fand bei NSAR häufiger Assoziationen mit hypoplastischem Linksherzsyndrom, Pulmonalstenose und Fallot-Tetralogie [21]. Für die meisten NSAR gibt es Fallberichte zu vorzeitigem Ductus-Verschluss im 3. Trimenon.
Teratogene: Als eindeutig teratogen gelten Retinoide und das Immunsuppresivum Mycophenolat, die beide mit Fehlgeburten und angeborenen Fehlbildungen einhergehen [14].
Noxen
Alkohol
Eine Studie in Finnland zeigte, dass unter den Müttern von Kindern mit konotrunkalen Fehlbildungen mehr Frauen angaben, in der Schwangerschaft Alkohol getrunken zu haben. Allerdings ergab sich daraus keine statistische Signifikanz für das vermehrte Auftreten von kardiovaskulären Fehlbildungen [22]. In der Baltimore Washington Infant Study fand man lediglich einen Zusammenhang mit der Häufigkeit kleiner muskulärer Ventrikelseptumdefekte [23].
Nikotin
Eine große Metaanalyse bestätigt den Zusammenhang zwischen Nikotinkonsum während der Schwangerschaft und angeborenen Herzfehlern [24]. Der Zusammenhang zwischen Rauchen in der Schwangerschaft und angeborenen Fehlbildungen ist jedoch eher schwach und vor allem bei Ventrikelseptumdefekten nachzuweisen [25].
Cannabis
In der Baltimore Washington Infant Study war Cannabis mit einem leicht erhöhten Risiko für Herzfehler assoziiert [26].
Koffein
Koffein passiert zwar die Plazenta, aber mehrere Studien haben die Assoziation von Koffeinkonsum (sogar > 8 Tassen/Tag) und fetalen Fehlbildungen untersucht und keinen Zusammenhang mit vermehrten Fehlbildungen feststellen können [27].
Ernährung
Eine in den USA durchgeführte Untersuchung zeigte unter Berücksichtigung vieler anderer Faktoren, wie unter anderem Folsäuresubstitution, Nikotinkonsum und Ethnie, ein selteneres Auftreten von konotrunkalen und Septumdefekten, wenn sich die Schwangere ausgewogener ernährte [28].
Folsäure
Folsäure ist ein Begriff, der die natürlich in der Nahrung vorkommenden Folsäureverbindungen und die künstlich hergestellte Folsäure zusammenfasst. Nahrungsfolate werden nur zu etwa 50 % im Darm aufgenommen [29]. Folsäure ist im Körper als Tetrahydrofolsäure aktiv und zusammen mit Vitamin B12 für die Methylierung der DNS und die Umwandlung von Homocystein in Methionin wichtig. Der 6. Schweizerische Ernährungsbericht von 2012 geht von einer unzureichenden Versorgung der Bevölkerung der Schweiz mit Folsäure aus. Geschätzt werden 295 μg Folsäure pro Tag verzehrt und damit weit weniger als die heute empfohlenen 400 μg [29]. Die lesenswerte Broschüre des Bundesamtes für GEsundheit (BAG) [29] illustriert anhand von Winter- und Sommermenüs eindrücklich, dass die empfohlenen 400 μg mit einer gesunden Durchschnittsernährung in der Schweiz kaum erreicht werden. Eine gesetzlich angeordnete Anreicherung von Mehl mit Folsäure wie in den USA und in Kanada wird in der Schweiz aufgrund des nicht auszuschließenden vermehrten Wachstums von Karzinomzellen bei bestehenden Krebserkrankungen nicht durchgeführt. Entsprechend gilt die aktuelle Empfehlung des BAG in der Schweiz [29]:
- Jede Frau, die schwanger werden möchte oder könnte, sollte täglich Folsäuretabletten in einer Dosierung von 0,4 mg einnehmen.
- Wenn synthetische Folsäure schon vor und während der ersten 12 Wochen der Schwangerschaft eingenommen wird, verringert sich das Risiko des Kindes für Neuralrohrdefekte und andere Fehlbildungen, wie zum Beispiel Lippen-Kiefer-Gaumen-Spalten oder Herzfehler.
- Bei jedem Kind besteht ein Risiko für Neuralrohrdefekte.
- Eine Ernährung mit viel Gemüse, Obst, Vollkornprodukten und so weiter, das heißt mit Lebensmitteln, die natürlicherweise reich an Folsäure sind, genügt nicht für die Prophylaxe von Neuralrohrdefekten, aber eine ausgewogene Ernährung ist in der Schwangerschaft und Stillzeit für die Gesundheit der Mutter und die Entwicklung des Kindes besonders wichtig.
Folsäure verhindert nicht nur angeborene Herzfehler. Sie wird auch häufig prophylaktisch verschrieben bei Einnahme von Substanzen, die mit vermehrtem Auftreten kongenitaler Herzfehler assoziiert sind (z. B. Trimethoprim-Sulfonamid-Kombinationen).
Folsäuredosis
Der Folattransport beim Menschen ist an verschiedene Systeme gekoppelt und entsprechend besteht ein genetischer Polymorphismus dieser Transportsysteme [30]. Bei ungenügender Funktion dieser Proteine werden diese auch als Risikofaktoren für Fehlbildungen wie Neuralrohrdefekte diskutiert [31]. So gesehen liegt die empfohlene Dosis von 0,4 mg vermutlich eher an der unteren Wirksamkeitsgrenze [4]. Da es hierzulande wohl eher um eine Überwindung von Engpässen im Folsäuremetabolismus aufgrund von Polymorphismen als um einen echten Mangel gehen dürfte, wäre eine etwas höhere Dosis vorteilhafter. Die Frage, ob Multivitaminpräparate oder lediglich Folsäure allenfalls in einer höheren Dosis perikonzeptionell zur Prävention von Herzerkrankungen und anderen Fehlbildungen effektiver wären, kann nicht definitiv beantwortet werden. Eine Analyse zweier Anfang der 90er-Jahre durchgeführter nicht randomisierter Studien [32] zeigt, dass Multivitaminpräparate verglichen mit alleiniger Gabe von hoch dosierter Folsäure (z. B. 5 mg/Tag) effektiver für die Prävention von Neuralrohrdefekten sind. Folsäure und Multivitaminpräparate mit 0,4 bis 0,8 mg Folsäure senken beide gleich häufig die Inzidenz kardiovaskulärer Anomalien. In der Praxis wird heute in der Regel für Frauen ohne Risikofaktoren ein Multivitaminpräparat mit 0,4 mg Folsäure empfohlen. Bei Risikofaktoren, wie einer vorangegangenen Schwangerschaft mit fetalem Neuralrohrdefekt oder bei Einnahme von Antiepileptika während der Schwangerschaft, werden 5 mg Folsäure bis zum Ende des 1. Trimesters gegeben.
Schlussfolgerungen
Der Einfluss von Umweltfaktoren auf das Risiko angeborener Herzfehler ist noch unklar, und direkte Schlüsse sind schwierig. Medikamente sollen nach der Klassifizierung der FDA streng fachärztlich überwacht abgegeben werden. Insbesondere Retinoide gelten als teratogen. Trotz einer Reihe von Studien bestehen noch erhebliche Unsicherheiten, welche Noxen wie stark mit angeborenen Herzfehlern assoziiert sind. Folsäure perikonzeptionell verhindert eine Reihe von Fehlbildungen, insbesondere kardiovaskuläre Defekte.
Der Beratung durch Medizinalpersonen und regelmäßigen Kampagnen kommt große Bedeutung zu, da ein hoher Prozentsatz der Schwangerschaften relativ ungeplant sind. Folsäure muss jedoch bereits vor der Konzeption eingenommen werden, um einen idealen Effekt zu erzielen. Weltweit kommen täglich 10.000 Kinder mit Fehlbildungen zur Welt. Durch eine konsequente Prophylaxe könnte dies gemäß Botto et al. [33] in einem Fünftel bis der Hälfte der Fälle durch konsequente Prophylaxe verhindert werden.
- Herzfehler sind häufig, aber teilweise potenziell vermeidbar.
- Bei maternaler PKU und maternalem Diabetes kann eine optimale Behandlung in der Schwangerschaft das Risiko reduzieren.
- Bei präkonzeptionellem Beginn reduziert eine Folsäure-Supplementierung das Risiko.
- Bei medikamentöser Behandlung der Mutter in der Schwangerschaft ist eine individuelle Medikamenten-spezifische Beratung nötig.
- Unter den Genussmittel-Drogen ist der Zusammenhang von Rauchen und VSD gesichert.
Roland W. Weber¹, Michèle-Chantal Stahel² |¹Universitäts-Kinderspital Zürich, Herzzentrum; ²Klinik für Geburtshilfe, Universitätsspital Zürich
Interessenkonflikt: Die Autoren geben an, dass keine Interessenkonflikte im Zusammenhang mit diesem Beitrag bestehen.
Erschienen in: Kinderärztliche Praxis, 2020; 91 (4) Seite 248-253