Das Mädchen mit den oben genannten sowie weiteren Symptomen und Befunden war im frühen Sommer mit seiner Familie im Hotelurlaub im Nahen Osten gewesen. Dort erkrankte das zuvor gesunde Kind mit blutigen Diarrhoen und ausgeprägtem allgemeinen Krankheitsgefühl. Wie lautet Ihre Diagnose?
Anamnese und Befund
Ein 11 Jahre altes Mädchen wird in der Notfallaufnahme der Kinderklinik vorgestellt. Das Kind war im frühen Sommer mit seiner Familie im Hotelurlaub im Nahen Osten gewesen. Dort erkrankte das zuvor ganz gesunde Mädchen mit blutigen Diarrhoen und ausgeprägtem allgemeinen Krankheitsgefühl. Der Bruder und die Mutter waren ebenfalls betroffen und die Familie reiste umgehend zurück nach Hause.
Zum Zeitpunkt der Vorstellung in der Kindernotaufnahme bestehen die blutigen Durchfälle seit 5 Tagen, zudem erbricht die Patientin rezidivierend. Es besteht nach wie vor kein Fieber und, bis auf eine Reduktion des Allgemeinzustandes, erbringt die körperliche Untersuchung keine Auffälligkeiten, die Vitalparameter sind normal.
Die Labordiagnostik demonstriert eine Leukozytose von 29.800/µl (Referenz 8.000 – 12.000/µl) und eine geringe Hyponatriämie von 133 mmol/l (135 – 145 mmol/l). Das CRP ist erhöht auf 47,2 mg/dl (< 0,8 mg/dl). In den darauffolgenden Tagen fällt der Hämoglobin-Wert von 15,2 g/dl auf 12,7 g/dl (11,9 – 14,7 g/dl), die Thrombozyten fallen von 190.000/µl auf 40.000/µl (140.000 – 440.000/µl), Leukozyten und CRP steigen an, ebenso die Serumwerte für Kreatinin von 0,38 mg/dl auf 3,8 mg/dl (< 0,81 mg/dl) und Harnstoff bis auf 166 mg/dl (< 38 mg/dl). Die LDH ist mit 3831 U/l (< 300 U/l) deutlich erhöht. Die venöse Blutgasanalyse demonstriert eine metabolische Azidose mit einem pH von 7,33 (7,35 – 7,45) und einem Bikarbonat von 17,5 mmol/l (21 – 25 mmol/l). Im Verlauf treten ein arterieller Hypertonus und eine zunehmende Oligurie auf. Die Nieren stellen sich sonographisch beidseits vergrößert und mit echoreichen Rinden dar.
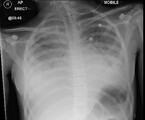
Aus diesem Grund erfolgt am 7. Krankheitstag die Verlegung der Patientin in ein kindernephrologisches Zentrum. Zu diesem Zeitpunkt besteht eine Anurie. Der Hb-Wert beträgt jetzt 8,6 g/dl, im Blutausstrich finden sich Fragmentozyten, die Thrombozyten betragen 44.000/µl. Angestiegen sind die Leukozyten auf 71.700/µl, das Kreatinin auf 5,6 mg/dl, der Harnstoff auf 168 mg/dl und das CRP auf 116 mg/dl. Nach wie vor bestehen eine leichte Hyponatriämie und eine metabolische Azidose. Im Röntgen-Thorax sind ein beidseitiger Pleuraerguss und ein geringes Lungenödem erkennbar (Abb. 1).
Anamnese, Befund und Laboruntersuchungen sprechen für ein hämolytisch-urämisches Syndrom (HUS).
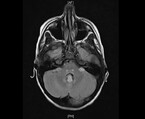
Umgehend erfolgt die Anlage eines Peritonealkatheters, um eine kontinuierliche Peritonealdialyse beginnen zu können. Die Flüssigkeitszufuhr wird beschränkt auf 400 ml/m² KOF/Tag („insensible losses“). Noch am Aufnahmeabend beklagt das Mädchen zunehmende Kopfschmerzen und Doppelbilder. Sie erscheint deutlich verwirrt und wesensgeändert. Die übrige neurologische Untersuchung und das EEG sind unauffällig. Die kranielle MR-Tomographie zeigt eine nahezu symmetrische Diffusionseinschränkung in den Basalganglien, aber keine offensichtlichen T2-Hyperintensitäten, außer im dorsalen Thalamus. Zudem sind diskrete Diffusionseinschränkungen im präzentralen Cortex erkennbar. Infratentoriell bestehen ebenfalls fast symmetrische punktförmige T2-Hyperintensitäten im dorsalen parazentralen Pons, in der Medulla oblongata und im Lobus flocculonodularis (Abb. 2). Hier ist keine Diffusionseinschränkung erkennbar. Hinweise für Blutungen, auch Mikrohämorrhagien, gibt es nicht, kein Hirnödem, unauffällige Liquorräume. Die Gefäßdarstellung und Perfusion sind unauffällig.
Am Folgetag kommt es zur kardiorespiratorischen Dekompensation (Tachypnoe, Tachykardie, Sättigungsabfall) des Kindes mit zunehmender Enzephalopathie, sodass die Verlegung auf die Intensivstation erfolgt. Bei ausgeprägtem Lungenödem und Pleuraergüssen (Abb. 3) wird mit der Hämofiltration begonnen. In der Echokardiographie ist eine deutlich eingeschränkte systolische Funktion beider Ventrikel erkennbar, das Troponin T ist mit 3329 ng/l (0 – 13 ng/l) stark erhöht. Es folgt eine einwöchige Katecholamin-Pflichtigkeit.
Die ergänzende Labordiagnostik zeigt folgende Ergebnisse: ADAMTS-13-Aktivität, C3, C4 normal, direkter Coombs-Test negativ, Stuhlkultur/-PCR ohne Erreger- oder Toxin-Nachweis.
Aufgrund der Schwere der Erkrankung mit kardialer und zerebraler Beteiligung und der noch unklaren HUS-Ätiologie, erfolgt die Gabe von Eculizumab, insgesamt zweimal. Schließlich gelingt der serologische Nachweis von E. coli O26. Die Patientin wird im Folgenden zurück auf Normalstation verlegt und die Peritonealdialyse wieder begonnen. Nach weiteren 3 Wochen Anurie setzt wieder eine geringe Urinausscheidung ein. Die klinisch-neurologischen und echokardiographischen Auffälligkeiten normalisieren sich. Das Mädchen kann nach einer insgesamt 2 Monate dauernden stationären Behandlung nach Hause entlassen werden mit Peritonealdialyse, Calcium- und Folsäuresubstitution bzw. antihypertensiver Medikation.
Weder der gesunde Bruder noch die an Diabetes mellitus Typ I vorerkrankte Mutter der Patientin erleiden ein HUS, beide erholen sich schnell von den blutigen Diarrhoen.
Im Verlauf kommt es zu einer Verschlechterung der chronischen Niereninsuffizienz, sodass knapp 2 Jahre nach Auftreten des HUS die regelmäßige Hämodialyse erforderlich ist und ein weiteres Jahr später eine Nierentransplantation erfolgt.
Definition des hämolytisch-urämischen Syndroms (HUS)
Das HUS ist charakterisiert durch die Trias aus mikroangiopathischer hämolytischer Anämie (MAHA) mit Fragmentozyten, Thrombozytopenie und akuter Nierenfunktionseinschränkung [1] und gilt als eine der häufigsten Ursachen für akutes Nierenversagen bei Kindern weltweit. Schon der Verdacht ist in Deutschland meldepflichtig.
Einteilung und Häufigkeit
Unterschieden werden seltene angeborene und deutlich häufigere erworbene HUS-Formen (Tab. 1). Das durch Shigatoxin-bildende enterohämorrhagische E. coli ausgelöste HUS (STEC-HUS) stellt die in der pädiatrischen Population mit Abstand am häufigsten auftretende HUS-Form dar: 90 % aller pädiatrischen HUS sind auf STEC zurückzuführen, also erworben. Vor allem Kinder unter 5 Jahren sind betroffen [2]. Das Komplement-vermittelte HUS, welches angeboren oder erworben auftreten kann, ist mit 5 bis 10 % aller pädiatrischen HUS deutlich seltener, aber das zweithäufigste [3]. Zu den weiteren, ausgesprochen seltenen Formen zählen Pneumokokken-, HIV-, H1N1 Influenza-A-assoziiertes HUS, Medikamenten-induzierte Formen und genetisch bedingte HUS-Subtypen (Diacylglycerolkinase- (DGKE)-Mutationen, Cobalamin-C-Mangel) sowie HUS im Rahmen anderer Grunderkrankungen.
Ätiopathogenese des STEC-HUS
Nur diejenigen E.-coli-Stämme, die Shigatoxin 2 produzieren, verursachen HUS [4, 5]. E. coli O157:H7 ist der am häufigsten vorkommende Serotyp weltweit, vergesellschaftet mit dem höchsten Risiko, HUS zu verursachen. 15 – 20 % der infizierten Kinder entwickeln ein HUS. Nicht-O157:H7 STEC gehen mit einem deutlich geringeren HUS-Risiko einher. Die zirkulierenden Shigatoxine führen zur Mikroangiopathie und konsekutiv zur Bildung von Mikrothromben. Diese thrombotische Mikroangiopathie (TMA) verursacht u. a. eine akute Nierenfunktionseinschränkung, kann aber auch andere Organe (zentrales Nervensystem, Myokard, Kolon, Pankreas) betreffen.
Klinik des STEC-HUS
2 bis 3 Tage nach Aufnahme der hochinfektiösen Erreger bestehen Bauchschmerzen, (blutige) Diarrhoen und Erbrechen, gefolgt vom plötzlichen Einsetzen der HUS-Trias 5 bis 10 Tage später. Zudem tritt häufig ein arterieller Hypertonus auf. Die Hälfte bis zwei Drittel aller Kinder muss dialysiert werden [6]. Andere Organsysteme sind häufig mitbetroffen: in 20 – 33 % das zentrale Nervensystem [6 – 8] mit Vigilanzstörung, zerebralen Anfälle, kortikaler Blindheit u. a. und entsprechenden cMRT-Veränderungen [9] sowie erhöhter Mortalität [10]. In 2 – 5 % kommt es zu kardialer Beteiligung mit eingeschränkter Kontraktilität u. a. durch Myokarditis, Ischämie etc. Transaminasenerhöhung, Leukozytose, transienter Diabetes mellitus und gastrointestinale Beteiligung sind weitere mögliche Symptome.
Diagnostik des STEC-HUS
Die Diagnose wird auf der Grundlage der klinischen und der Laborbefunde mit der o. g. typischen Trias gestellt und muss durch ergänzende serologische und bakteriologische Diagnostik gesichert werden.
Differenzialdiagnose
Als wichtigste Differenzialdiagnosen sind die Disseminierte Intravasale Koagulopathie (DIC) und die Thrombotisch-Thrombozytopenische Purpura (TTP) zu nennen. Die DIC geht mit einer pathologischen Gerinnung einher und betrifft meist lebensbedrohlich kranke Kinder. Bei der TTP handelt es sich um einen angeborenen oder erworbenen ADAMTS-13-Mangel. Die Behandlungsstrategien unterscheiden sich jeweils grundlegend.
Therapie des STEC-HUS
Die HUS-Therapie ist vor allem supportiv mit Bluttransfusionen, Flüssigkeits- und Elektrolytmanagement, Dialyse, antihypertensiver Medikation. Bei schwerer neurologischer Mitbeteiligung kann Eculizumab (monoklonaler C5-Antikörper) verabreicht werden, wobei die aktuelle Datenlage hierzu nicht eindeutig ist [11 – 15]. Gegebenenfalls ist diese Behandlung auch bei kardialer Mitbeteiligung sinnvoll.
- Das hämolytisch-urämische Syndrom (HUS) wird klinisch und durch geeignete Laboruntersuchungen diagnostiziert anhand der typischen und krankheitsdefinierenden Symptomentrias: mikroangiopathische hämolytische Anämie (MAHA), Thrombozytopenie und akute Nierenfunktionseinschränkung.
- Das STEC-HUS ist mit 90 % aller pädiatrischen HUS am häufigsten.
- E. coli O157:H7 ist der am häufigsten vorkommende Serotyp weltweit, wobei Nicht-O157:H7 STEC an Bedeutung zunehmen.
- Differenzialdiagnostisch sind DIC und TTP umgehend auszuschließen, da sich hieraus konkrete Therapien ergeben.
- Die HUS-Therapie ist vor allem symptomatisch und sollte bei schwerer Erkrankung an einem kindernephrologischen Zentrum erfolgen.
- Eculizumab steht bei STEC-HUS als medikamentöse Therapie bei ZNS- und kardialer Beteiligung zur Verfügung.
| [1] | Klinik für Kinder- und Jugendmedizin, Universitätsmedizin Göttingen; | |
| [2] | Department of Paediatric Nephrology, Evelina London Children’s Hospital, Guy’s and St Thomas’ NHS Foundation Trust, London, UK |
Dr. med. Janine Wöllner
Erschienen in: Kinderärztliche Praxis, 2022; 93 (2) Seite 108-112